[더구루=이연춘 기자] 대웅제약은 세계 최초 신약(First-in-class)으로 개발 중인 특발성 폐섬유증(Idiopathic Pulmonary Fibrosis, IPF) 치료제 ‘베르시포로신(DWN12088)’의 임상 2상(NCT05389215)에서 3차 독립적 데이터 모니터링 위원회(Independent Data Monitoring Committee, IDMC)로부터 안전성 확인 및 임상 지속 권고를 재확인받았다.
대웅제약은 27일 지난 9월 23일 열린 3차 IDMC 회의에서는 등록 환자 89명을 포함한 중간 안전성 데이터가 심층 검토됐으며, 임상 지속에 영향을 미칠 중대한 이상 소견은 발견되지 않았다고 밝혔다.
이에 따라 대웅제약은 베르시포로신의 임상 2상을 계획대로 진행 중이며, 현재까지 전체 목표(102명)의 약 92%에 해당하는 94명의 환자 모집을 완료했다.
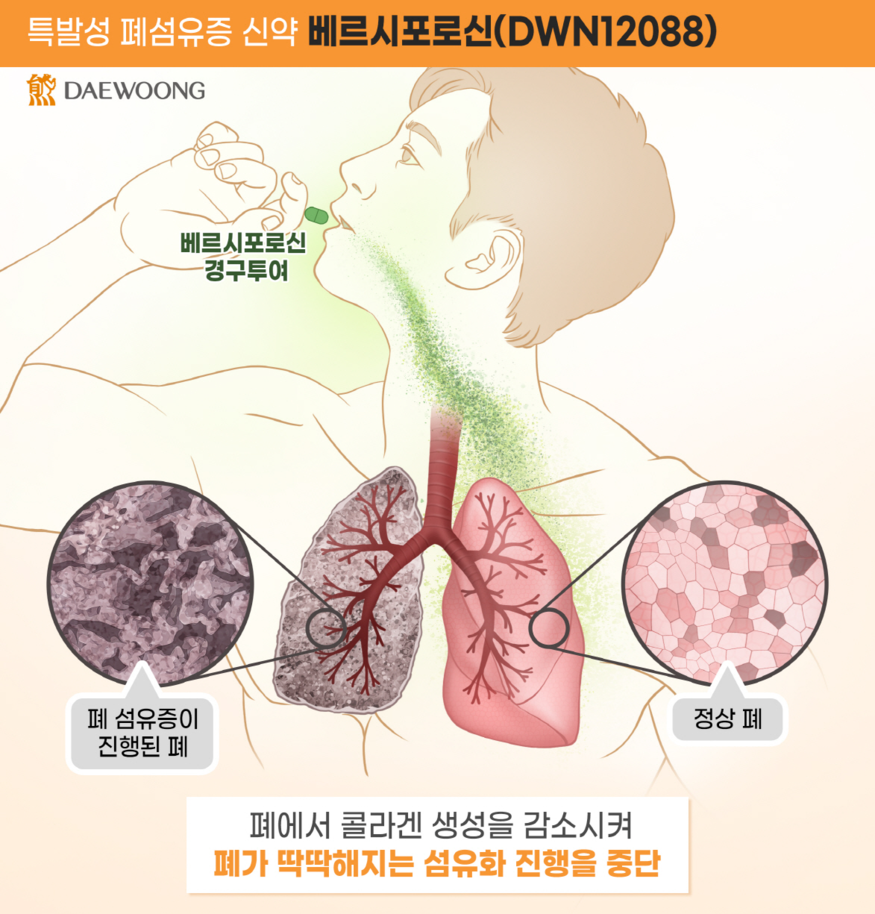
특발성 폐섬유증은 폐의 섬유화가 점진적으로 진행되어 호흡 기능이 저하되는 희귀질환으로, 현재 승인된 치료제는 질환의 진행을 늦추는 수준에 머물러 근본적인 치료 효과가 제한적이다. 이에 따라 기존 치료제의 한계를 극복할 수 있는 새로운 기전의 신약 개발 필요성이 커지고 있다.
베르시포로신은 콜라겐 합성의 핵심 효소인 Prolyl-tRNA Synthetase(PRS)를 선택적으로 억제함으로써, 섬유화의 근본 원인을 차단하는 새로운 기전을 갖는 치료제다. 현재 진행 중인 임상 2상에서는 40세 이상의 특발성 폐섬유증 환자를 대상으로 베르시포로신 단독 투여 또는 기존 치료제(닌테다닙, 피르페니돈) 병용 투여 시의 안전성, 내약성, 유효성을 평가하고 있다.
이번 임상은 한국과 미국의 주요 연구기관에서 동시 진행 중이며, 한국에서는 서울아산병원, 신촌세브란스병원, 삼성서울병원, 순천향대 부천병원, 부천성모병원, 아주대병원, 명지병원, 울산대병원, 인제대 부산백병원 등 10개 기관이 참여하고 있다.
또한 오는 30일 대한결핵및호흡기학회 국제학술대회(KATRD International Conference 2025)에서 서울아산병원 호흡기내과 송진우 교수(임상시험 책임연구자)가 등록 환자 92명의 중간 특성 분석 결과를 포스터로 발표할 예정이다.
발표에서는 한국과 미국에서 등록된 환자군 간의 주요 인구학적·기능적 특성과 병용 치료 비율 등 임상적 특성이 공개되며, 이러한 결과는 베르시포로신의 임상적 유의성 및 인종별 치료 반응 특성을 평가하는 데 중요한 근거 자료로 활용될 전망이다.
박성수 대웅제약 대표는 “이번 3차 IDMC 결과는 베르시포로신의 안전성을 재확인한 중요한 이정표”라며, “임상 2상을 차질 없이 진행해 특발성 폐섬유증 환자들에게 새로운 치료 대안을 제시하겠다”고 밝혔다.

